Олімпіадна задача №2. Донорно-акцепторний зв’язок
Молекули NH3, N(CH3)3, AlCl3, AsCl3 та GeCl4 при взаємодії між собою можуть утворювати донорно-акцепторні комплекси.
1. Які з перелічених речовин є кислотами, а які – основами Льюїса?
2. Зобразьте просторову конфігурацію молекул а) NH3; б) N(CH3)3; в) AlCl3; г) AsCl3; д) GeCl4.
3. Як змінюється геометрична форма при утворенні донорно-акцепторних комплексів: а) Cl3Al*NH3; б) Cl3As*N(CH3)3; в) Cl4Ge*N(CH3)3? Зобразьте форму комплексів. Поясніть, чому при утворенні комплексу геометрія акцепторного фрагмента може зазнати суттєвих змін, в той час як геометрія донорного фрагмента змінюється незначно (використовуйте метод відштовхування валентних електронних пар Гіллеспі).
4. В якому з комплексів зв’язок Al–N довший:
а) Cl3Al*NH3 чи Cl3Al*N(CH3)3; б) Cl3Al*N(CH3)3 чи Н3Al*N(CH3)3;
в) Н3Al*N(CH3)3 чи (СН3)3Al*N(CH3)3?
Свій вибір обґрунтуйте.
Дивіться детальний розв'язок.
1. AlCl3, AsCl3, GeCl4 – кислоти Льюїса (акцептори пари електронів), NH3, N(CH3)3 – основи Льюїса (донори пари електронів).
2. Форми молекул: NH3, N(CH3)3, AsCl3 – тригональні піраміди; AlCl3 – майже плоска; GeCl4 – тетраедр.
3. При утворенні комплексу неподілена електронна пара донора притягується акцептором. Її взаємодія зі зв’язуючими електронними парами донора зменшується. При цьому валентні кути у донорному фрагменті збільшуються. Утворений координаційний зв’язок відштовхує зв’язуючі електронні пари акцептора, що спричиняє зменшення валентних кутів в акцепторному фрагменті. У комплексі виникає також відштовхування безпосередньо зв’язаних атомів, що зменшує валентні кути як у донорному, так і в акцепторному фрагментах. В результаті геометрія AlCl3 з майже плоскої переходить у пірамідальну, геометрія AsCl3 з пірамідальної переходить у геометрію типу SF4 (викривлений тетраедр), геометрія GeCl4 з тетраедричної переходить у тригонально-біпірамідальну.
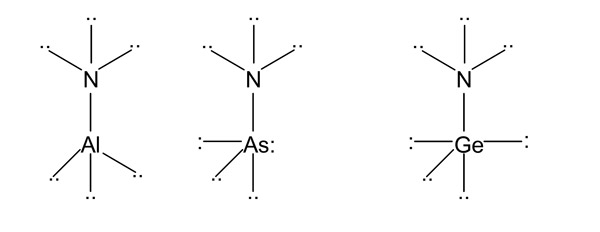
4. В комплексах X3Al–NR3 зв’язок Al–N скорочується зі збільшенням електронегативності ліганду Х при атомі алюмінію (посилюються акцепторні властивості). Зв’язок Al–N подовжується зі зростанням електронегативності ліганду R при атомі N (донорні властивості стають менш вираженими). а) Cl3Al*NH3, б) Н3Al*N(CH3)3, в) (СН3)3Al*N(CH3)3.